Experimento meteorológico: Contracción y expansión térmica del aire
Experimento Nº 2: Contracción y expansión térmica del aire Francisco Martín LeónMeteorólogoColaborador en este experimento: Miguel Martín del RíoNotas preliminares Siguiendo con la línea de realizar e...

Experimento Nº 2: Contracción y expansión térmica del aire
Francisco Martín León
Meteorólogo
Colaborador en este experimento: Miguel Martín del Río
Notas preliminares
Siguiendo con la línea de realizar experimentos meteorológicos caseros o de “cocina”, os presentamos en segundo de ellos. El objetivo general de todos ellos es mostrar y aprender aspectos prácticos de la meteorología que están en la vida cotidiana, bien cerca de nosotros o bien sobre nuestras cabezas. Y todo ello, usando materiales y utensilios de casa.
Al ser la RAM una revista digital (www.tiempo.com/ram/) y poseer un Foro propio (https://foro.tiempo.com/), hemos pensado llevar a cabo bimensualmente unos experimentos simples y fáciles de hacer. Pedimos la colaboración de los interesados de forma que en el plazo de un mes se recojan vuestras experiencias, comentarios y fotografías. Todo ellos servirá para realizar un documento que se ubicará en el correspondiente número de la RAM.
Cuando se muestren los principios básicos del experimento, podréis colgar vuestras opiniones, ensayos, variantes, comentarios, sugerencias, problemas y resultados, con o sin fotografías del experimento propuesto cada mes.
Esperamos vuestra contribución a esta nueva experiencia que para muchos de vosotros creemos que será gratificante.
Ya está realizado el primer experimento meteorológico de la RAM en su Foro:
Consideraremos colaboradores a aquellas personas que hayan realizado el experimento de forma satisfactoria y nos lo envíen o pongan en los foros respectivos las fotos, sus comentarios y sugerencias. Las fotos y texto deben de poseer una calidad mínima; en caso contrario, no podremos reproducirlos en la RAM.
Saludos cordiales,
Experimento 2º: Descripción
Analizar la contracción y expansión térmica del aire.
- Nivel del experimento. Muy fácil
- Material necesario.
• Un huevo duro, sin cáscara.
• Una botella o recipiente base transparente con una embocadura algo menor que el diámetro del huevo duro (éste no debe caer al interior por si mismo, si lo ponemos con su sección más estrecha en el orificio de entrada de la botella base).
• Un recipiente-1 para calentar agua y mantenerla caliente.
• Otro recipiente-2 que sirva como contenedor de agua fresca del grifo.
• Cubitos de hielo.
• Unos guantes de cocina o trapo apropiado que nos proteja del calor, si fuera necesario.
La botella base debe caber dentro de ambos recipientes (-1 y -2) y ser mínimamente resistente a los cambios de temperatura. Cualquier botella casera cumple estos requisitos. Si posee un largo cuello la botella, tanto mejor pues más espectacular es el experimento.


Si dispones de material de laboratorio en tu colegio, instituto, etc., puedes sustituir la botella base por un matraz de un único orificio de entrada, cuello alargado y de base plana y ancha. Los matraces suelen ser muy resistentes a los cambios térmicos. El recipiente-1 de calor puede ser eliminado y dejar sólo un foco de calor y un posa matraz donde podamos calentarlo. El recipiente-2 puede ser otro recipiente ancho de laboratorio donde podamos meter el matraz base.
- Material optativo. Cámara de fotos o de video para la toma de lo que acontece en el experimento.
- Tiempo invertido. Poco tiempo, si todo el material está disponible, menos de 30 min., aproximadamente.
- Precauciones. Como siempre, ¡cuidado con los focos de calor!. Ninguno en especial si se hace con cuidado. Si eres menor de edad, trata de hacer las cosas acompañado de un adulto.
- Parte I
1.- Prepara un huevo duro sin cáscara. Este será o actuará como tapón de la botella, matraz o recipiente base. El tamaño y sección menor del huevo debe ser algo mayor que la embocadura de la botella o recipiente base de trabajo. Ese “tapón” no debe caer por si solo dentro del recipiente base, bien por su peso. Tampoco debe ser demasiado estrecha la abertura de la botella como para impedir el paso del huevo duro.
2.- Calienta, en un recipiente-1 adecuado, agua. Cuando esté a punto de hervir, se retira y lo colocamos sobre un plato. Mientras, utiliza agua caliente del grifo para llenar la botella o recipiente base, para adecuarla y adaptarla al agua caliente del recipiente-1 que estuvo puesta al fuego. El objetivo es que la botella base esté algo caliente y no “sufra” al sumergirla, parcialmente, en el recipiente con agua caliente.
Pon la botella, ya vacía y algo caliente, dentro del recipiente-1 con el agua caliente y con el tapón especial: el huevo duro. Cuidado que no se caiga la botella o pierda el equilibrio dentro del recipiente de agua caliente. No hace falta que el agua esté hirviendo, sólo que esté caliente. Deja que la botella y el aire de su interior se calienten un rato dentro del recipiente con agua. Con un minuto o dos es suficiente. Cuidado no te quemes.
3.- Mientras se calienta la botella y el aire de dentro, llena otro recipiente hasta la mitad con agua fresca del grifo y rellénala con hielo en cantidad, hasta que el agua esté muy fría. Esto lo puedes hacer mientras estuviste calentado el agua y realizando el apartado 2.
4.- Después de un rato, y con las manos protegidas con un guante o trapo, saca la botella caliente con el huevo duro sobre su embocadura y acto seguido coloca la botella en el recipiente con agua fría. Observa qué le pasa al “tapón” que habíamos colocado con anterioridad.
Mira y examina qué está ocurriendo con el huevo.


El huevo duro y flexible ha penetrado por el cuello de la botella y ha pasado al interior, sin que nadie lo tocara.
- Parte II
Sacamos en huevo desde el interior por el mismo sitio.
1.- Vamos a sacar el huevo del fondo del recipiente. Saca la botella base del recipiente-2 e inviértela. Trata de que el huevo tapone fijamente el cuello de la botella por el interior. Si no se queda fijo, aplícale unos movimientos bruscos de centrifugación para que el huevo se quede interiormente como un tapón.
2.- Una vez conseguido esto, coloca la botella taponada en el interior del recipiente de agua caliente, mirando hacia arriba. Si el agua caliente se ha enfriado, coloca el recipiente-1 al fuego hasta que se caliente el agua de nuevo.
Deja la botella un rato sumergida en agua caliente.
3.- El huevo, que taponaba el cuello de la botella por el interior, comienza a subir por dicho cuello hasta que sale completamente al exterior.



¿Qué ha pasado?. El huevo ha ascendido hacia arriba por el cuello de la botella.
Las respuestas a lo preguntado anteriormente están en los principios físicos y termodinámicos por los que se rigen el aire, que nos es ni más ni menos que un gas casi ideal.
Principios básicos del experimento. Los gases ideales
Los gases ideales, para nuestro propósito, son aquellos en que la relación entre la presión a la que están sometidos, P, el volumen que ocupan, V, y su temperatura, T, que poseen están relacionadas por una expresión matemática muy simple:
PV=KT (1)
Siendo K una constante. Para nuestros propósitos esta fórmula puede ser suficiente.
De esta relación podemos obtener otras tantas, como vamos a ver a continuación. Históricamente se obtuvieron las tres siguientes leyes que vamos a enumerar antes que la (1), que las unifica de forma elegante. Así por ejemplo, si:
a.- Si mantenemos la T constante
Entonces,
PV= c siendo “c” una constante.
Esta expresión nos dice que, si aumentamos la presión sobre el gas a temperatura constante, su volumen disminuirá inversamente para mantener el producto constante, y viceversa. En 1661, Robert Boyle y Robert Hook, su ayudante, realizaron varios experimentos en Inglaterra que le llevaron a enunciar la primera ley de los gases ideales. Al mismo tiempo, el francés Edme Mariotte llegaba a la misma conclusión. A esta ley se le denomina ley de Boyle-Mariotte en horno a sus descubridores.
La presión de una cantidad fija de gas es inversamente proporcional al volumen que ocupa, siempre y cuando se mantenga la temperatura constante.
Ver animación de esta ley aqui.
Pon el sonido activo en tu terminal.
b.- Si la presión, P, la mantenemos constante
En este caso,
V=d T siendo d otra constante.
Esta ley nos dice que, si aumentamos la temperatura de un gas a presión constante, su volumen, V, aumentará y viceversa.
En 1787, Jacques Charles investigó la relación existente entre el volumen y la temperatura de un gas a presión constante. Al conservar la presión constante, el volumen aumenta y cuando la temperatura disminuye, el volumen también disminuye. Luego, había una proporcionalidad directa entre el volumen y la temperatura, a presión constante, a la cual se le conoce como Ley de Charles.
Un ejemplo típico lo tenemos en un globo: lleno de aire aumenta su volumen cuando se le calienta y lo disminuye cuando se le enfría.
Charles no publicó sus descubrimientos pero sí se le reconoce su esfuerzo por la Ley de Charles:
El volumen de un gas a presión constante es directamente proporcional a la temperatura (en grados kelvin).
Ver animación de esta ley aquí.
c.- Si el volumen V, donde está contenido el gas, se hace constante
Tenemos,
P=f T (2) siendo f otra constante
Esta expresión nos dice que, a volumen constante, un aumento de temperatura de un gas ideal se corresponde inmediatamente con un aumento de la presión y viceversa.
Otra forma de ponerla es:
Po/To=P1/T1=P2/T2 =f
Joseph Gay Lussac, francés, descubrió esta ley y sacó a la luz la anterior, que ya había sido descubierta por Charles.
Ver animación y explicación de esta ley aquí.
El aire como un gas casi perfecto
No existe un gas al 100% perfecto, o sea, un gas donde sus variables P,V y T estén relacionadas por ecuación (1). Los gases ideales, y su formulismo físico-matemático, nos sirven para estudiar a los gases reales. En esta línea, aire (seco o cargado de humedad) se comporta casi como un gas ideal y, para nuestros propósitos, la relación que existe entres la P, V y T a la que está sometido, es tal que sigue la ecuación (1).
Centrémonos ahora en el caso “c”.
Procesos del aire a volumen constante: enfriamientos y calentamientos del aire
Supongamos que disponemos de una porción de aire encerrado en cilindro a un volumen,V, constante a unas condiciones iniciales de presión Po y temperatura To. Al aumentar la T1 (>To) del recipiente, el aire interior se calienta, se expande y ejercerá una presión P1 (>Po). Esto es así para mantener constante su cociente según (2).
Po/To= P1/T1= P2/T2= f
Supongamos ahora que el aire del recipiente de partida está a la misma presión atmosférica y temperatura que el exterior, Po y To, respectivamente. A la cara del cilindro superior se le permite leves deslizamientos verticales. Si suministramos calor al cubo o cilindro y elevamos la temperatura del aire de su interior, pasaremos de To a T1 y tal que T1> To. Al ser un gas perfecto, y según lo comentado anteriormente, P1>Po (presión exterior). La superficie móvil ascenderá al ser la presión del interior mayor que la exterior, al ser calentado el gas del recipiente. El gas se ha expandido
El mismo proceso se puede repetir si partimos de To y Po y enfriamos en interior del cilindro: el aire pasará a una T2 y P2 con T2< To y P2
Para nuestros propósitos, despreciaremos la fuerza de resistencia que ofrece el vidrio de la botella al paso del huevo por su cuello.
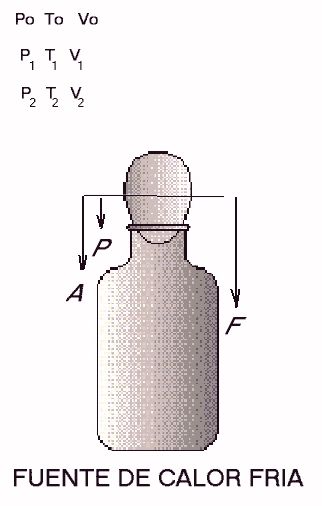
Al pasar la botella al recipiente con agua caliente, la temperatura y presión del aire en el interior, P1 y T1, son tales que P1>Po. La fuerza resultante debido a la diferencia de presión, S, tenderá a sacar el huevo del recipiente.
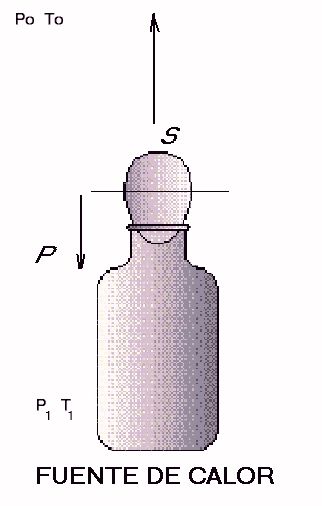
La presión P1 y la temperatura, T1, del aire del interior son superiores a las del exterior. En este caso, si la fuerza S es mayor que el peso del huevo, éste saldrá de la botella. Ahora la diferencia P1 –Po>0 y tiende a expulsar al huevo que tapona la parte interior del cuello de la botella.
Estos hechos ocurren en la naturaleza donde burbujas de aire dentro de globos en contacto con fuentes de calor o frío (suelo calentado por el sol o enfriado por la pérdida de calor) se dilatan o se contraen térmicamente, modificando su densidad. Otro de los hechos llamativos y relacionados con estos eventos es las dilataciones y compresiones que experimentan las botellas de plásticos cerradas y vacías de líquidos al subir o bajar de las montañas, por citar algún ejemplo.
Detalles básicos del Experimento 2º
Ya estamos en condiciones de explicar qué acontece con el huevo duro que actúa como tapón en un recipiente que contiene aire y que es sometido a cambios de temperaturas en baños caliente y frío.
I. Al sumergir la botella en un recipiente de agua muy caliente, lo que estamos haciendo es calentar el aire del interior a una T1, tal que T1> To, siendo To la temperatura del exterior. El peso del huevo y la presión atmosférica exterior, Po, equilibran la interior, P1.
II. Cuando pasamos la botella o recipiente a la fuente fría (bandeja con agua fría e hielo) el aire del interior de la botella se enfría a T2, siendo T2< To y por lo tanto, a volumen constante, la P2 del interior del recipiente es tal que P2
III. Si se coloca el huevo como tapón en el interior del cuello de botella y ésta la pasamos al recipiente de agua muy caliente, entonces el aire del interior pasa a una T1>To y P1>Po que será, a su vez, con el tiempo cronológico mayor que To. El resultado es que P1> Po y el huevo, poco pesado y ligero, subirá por el cuello de botella hasta su embocadura. El huevo habrá salido de nuevo al exterior.
Ha aquí lo acontecido en animaciones cuando realizamos los procesos (esta vez con otro tipo de botella o recipiente básico). La secuencia se ha realizado con una cámara digital fotográfica en formato mjp:
• I-II Bajada del huevo duro por contracción del aire de la botella (5.3 Mb)• II-III Subida del huevo duro por dilatación del aire dilatación del aire de la botella (4.6 Mb).
Un poco de historia de las leyes y sus personajes
Hagamos un poco de historia de las personas que enunciaron las anteriores leyes y que muchas veces sólo conocemos sus nombres por la propia ley.
Robert Boyle (1627-1691)
Científico británico, uno de los primeros defensores de los métodos científicos y uno de los fundadores de la química moderna.
Nació en Lismore, Irlanda, y estudió en Ginebra, Suiza. Se estableció en Inglaterra y se dedicó a la investigación científica. Boyle es considerado uno de los fundadores de los métodos científicos modernos porque creyó en la necesidad de la observación objetiva y de los experimentos verificables en los laboratorios, al realizar los estudios científicos.
Boyle fue el primer químico que aisló un gas. Perfeccionó la bomba de aire y sus estudios le condujeron a formular, independientemente de su colega francés Edme Mariotte, la ley de física conocida hoy como “ley de Boyle-Mariotte”. Esta ley establece que a una temperatura constante, la presión y el volumen de un gas son inversamente proporcionales. En el campo de la química, Boyle observó que el aire se consume en el proceso de combustión y que los metales ganan peso cuando se oxidan. Reconoció la diferencia entre un compuesto y una mezcla, y formuló su teoría atómica de la materia basándose en sus experimentos de laboratorio. En su obra El químico escéptico (1661), Boyle atacó la teoría propuesta por el filósofo y científico griego Aristóteles (384-322 a.C.) según la cual la materia está compuesta por cuatro elementos: tierra, aire, fuego y agua. Propuso que partículas diminutas de materia primaria se combinan de diversas maneras para formar lo que él llamó corpúsculos, y que todos los fenómenos observables son el resultado del movimiento y estructura de los corpúsculos. Boyle fue también el primero en verificar las diferencias entre ácidos, bases y sales. Entre sus obras están Origen de formas y características según la filosofía corpuscular (1666) y Discurso de las cosas más allá de la razón (1681). Boyle fue uno de los miembros fundadores de la Royal Society de Londres.
En 1660, en una obra titulada Sobre la Elasticidad del Aire anunció su descubrimiento sobre la relación entre el volumen de un gas y su presión.
Parece que Boyle no especificó en sus trabajos que sus experiencias de la relación entre el volumen y presión los realizó a temperatura constante, quizá porque lo hizo así y lo dio por supuesto. Lo cierto es que, en defensa del rigor científico, hay que esperar a que en 1676 otro físico, el francés Edme Mariotte (1630-1684), encuentre de nuevo los mismos resultados y aclare que la relación PV=constante es sólo válida si se mantiene constante la temperatura. Por eso la ley de Boyle está referenciada en muchas ocasiones como Ley de Boyle y Mariotte.
Joseph Louis Gay-Lussac (1778-1850)
Químico y físico francés conocido por sus estudios sobre las propiedades físicas de los gases. Nació en Saint Léonard y estudió en la École Polytecnique y en la École des Ponts et Chaussées de París. Después de impartir la enseñanza en diversos institutos fue, desde 1808 hasta 1832, profesor de física en la Sorbona.
En 1804 realizó una ascensión en globo para estudiar el magnetismo terrestre y observar la composición y temperatura del aire a diferentes altitudes. En 1809 formuló la ley de los gases que sigue asociada a su nombre.
La ley de Gay-Lussac de los volúmenes de combinación afirma que los volúmenes de los gases que intervienen en una reacción química (tanto de reactivos como de productos) están en la proporción de números enteros pequeños. En relación con estos estudios, investigó junto con el naturalista alemán Alexander von Humboldt, la composición del agua, descubriendo que se compone de dos partes de hidrógeno por una de oxígeno. Unos años antes, Gay-Lussac había formulado una ley, independientemente del físico francés Jacques Alexandre Charles, que afirmaba que el volumen de un gas es directamente proporcional a su temperatura absoluta si la presión se mantiene constante; hoy se conoce como ley de Charles y Gay-Lussac.
En 1809 Gay-Lussac trabajó en la preparación del potasio y el boro e investigó las propiedades del cloro y del ácido cianhídrico. En el campo de la industria química desarrolló mejoras en varios procesos de fabricación y ensayo. En 1831 fue elegido miembro de la Cámara de los Diputados y en 1839 del Senado.
Jacques Alexandre César Charles (1746-1823)
Jacques Alexandre César Charles, químico, físico y aeronauta francés, nació en Beaugency (Loiret) el 2 de noviembre de 1746 y falleció en París el 7 de abril de 1823.
Al tener noticias de las experiencias de los hermanos Montgolfier con su globo aerostático propuso la utilización del hidrógeno, que era el gas más ligero que se conocía entonces, como medio más eficiente que el aire para mantener los globos en vuelo.
En 1783 construyó los primeros globos de hidrógeno y subió él mismo hasta una altura de unos 2 km, experiencia que supuso la locura por la aeronáutica que se desató en la época.
Su descubrimiento más importante fue en realidad un redescubrimiento ya que en 1787 retomó un trabajo anterior de Montons y demostró que los gases se expandían de la misma manera al someterlos a un mismo incremento de temperatura.
El paso que avanzó Charles fue que midió con más o menos exactitud el grado de expansión observó que por cada grado centígrado de aumento de la temperatura el volumen del gas aumentaba 1/275 del que tenía a 0°C . Esto significaba que a una temperatura de -275 °C el volumen de un gas sería nulo (según dicha ley) y que no podía alcanzarse una temperatura más baja.
Dos generaciones más tarde Kelvin fijó estas ideas desarrollando la escala absoluta de temperaturas y definiendo el concepto de cero absoluto.
Charles no público sus experimentos y hacia 1802 Gay-Lussac publicó sus observaciones sobre la relación entre el volumen y la temperatura cuando se mantiene constante la presión por lo que a la ley de Charles también se le llama a veces ley de Charles y Gay-Lussac.
Referencias
Links animados, sonoros y bibliográficos