¿Por qué se le echa sal a la nieve y al hielo?
Durante el invierno en situaciones de nevadas y ambiente muy frío es frecuente agregar sal al hielo para que se derrita. Y este hecho ocurre incluso antes de que nieve.

Específicamente lo que se derrite no es el hielo, sino la mezcla del hielo y la sal llamado "eutéctico".
Cuando la sal NaCl (Na+, Cl-) entra en contacto con el hielo, los iones se arreglan alrededor de las moléculas de agua, que son polares (H2?+, O?-) y viene a formar un compuesto (H2O).(NaCl). Para este re-arreglo hacen falta solamente unos pequeños movimientos de átomos, y se hace por lo tanto en fase sólida.
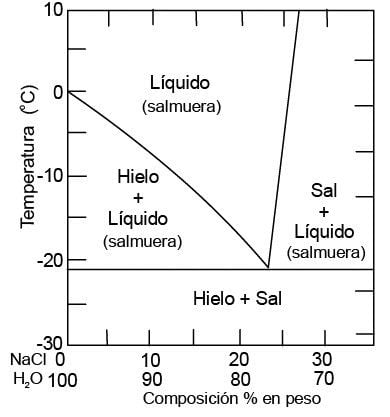
Cuando se respetan las proporciones exactas (alrededor del 77 % de sal en masa), se tiene un producto que se comporta como producto puro (particularmente, hay una temperatura de fusión constante) y que se califica de "eutéctica". La temperatura de fusión de esta eutéctica es de alrededor de -21 °C. Si la proporción de sal es inferior a esta relación, se da una mezcla agua-eutéctica, que se funde a una temperatura superior a la del agua pura, que es de 0ºC. La mezcla se fundirá siempre entre -21 y 0 °C. Si la proporción de sal es superior, se tiene una mezcla sal-eutéctica que también se funde a una temperatura superior.
¿Por qué la sal derrite el hielo?
El hielo es uno de los tres estados naturales del agua. Básicamente es agua sólida cristalizada, congelada. El agua pura a la altitud del nivel del mar se congela a 0 ºC y la densidad del hielo a esta temperatura es de 0,9169 gr/cm3.
Cuando el hielo y el agua están en contacto, las moléculas de la superficie de hielo se funden en el agua (fusión), y las moléculas de agua son capturadas en la superficie del hielo (congelación). Cuando la cantidad de congelación es la misma que la de fusión, el hielo y el agua están en equilibrio dinámico entre sí. El equilibrio entre la congelación y el deshielo se puede mantener a 0 ºC, el punto de congelación del agua, a menos que cambien las condiciones de una forma que favorezcan un proceso u otro. Este equilibrio se rompe fácilmente por efecto de la temperatura: si aumentamos la temperatura favorecemos la fusión y si esta desciende se favorece la congelación.
El descenso crioscópico y la sal
Pero este equilibrio dinámico también se rompe al añadir sal. Cuando añadimos sal al hielo lo que se funde no es el hielo sino una mezcla de hielo y sal.
Cuando la sal NaCl (Na+, Cl–) entra en contacto con el hielo, los iones se combinan con las moléculas altamente polares del agua (H2?+, O?–) y forman un compuesto (H2O).(NaCl). Esta mezcla tiene un punto de congelación inferior a 0º C y es la base de la aplicación de hielo en las carreteras.
El descenso crioscópico es la reducción del punto de fusión de un disolvente puro que se consigue por la presencia de solutos.
¿Cualquier sustancia extraña nos permitiría rebajar el punto de congelación?
Pues si, por cada mol de partículas extrañas disueltas en un kilo de agua, el punto de congelación baja en aproximadamente 1,7-1,9 ° C. Se podría añadir azúcar, alcohol, u otras sales que también bajaríamos el punto de congelación y derretiríamos el hielo. El descenso crioscópico es directamente proporcional a la molalidad o cantidad de soluto por kilo de disolvente. Lógicamente se usa las partículas y elementos más baratos y fáciles de obtener y transportar: la sal.
La proporción de sal
Existe una proporción de sal en agua que se comporta como si fuera una sustancia pura, técnicamente es lo que se califica como “eutéctica”, que en el caso de la sal es de un 23% de sal en masa. La temperatura de fusión de esta sustancia eutéctica es de alrededor de -21 °C. Esta proporción de sal en agua es la concentración ideal con la que conseguiríamos la menor temperatura de congelación. Tanto si la proporción de sal es inferior como si es superior a esta cantidad la temperatura de congelación es superior (entre -21 °C y 0 °C). Esto lo vemos claramente en el diagrama de fase que representa la temperatura de fusión en función de las proporciones sal-agua.
¿Por qué sal en las carreteras?
La sal se utiliza en las carreteras y caminos, simplemente porque es barata y fácilmente disponible. Sin entrar a valorar la eficacia de la sal frente a otros productos que en cualquier caso también dependerá de la granulometría, de los métodos de reparto, del tipo de asfalto de la carretera, etc. existe un debate importante en cuanto a la repercusión ecológica del uso masivo de este producto en nuestras carreteras. La sal se diluye en agua y ésta corre por ríos, acuíferos y demás, y además se cuestiona que repercusiones tendrá su uso a largo plazo.
En ciudades de Centro Europa se ha comprobado como su utilización producía daños en la mayoría de los árboles de estas ciudades. Además de la corrosión que provoca a los vehículos su utilización en las carreteras. Ahora, bien es verdad que en Canadá se prohibió y los accidentes de tráfico se dispararon.
Se está planteando como alternativa, principalmente la utilización de arenas, cenizas o gravillas que tienen la ventaja de ser más biodegradables y con una eficiencia similar a menor coste, ya que logran sin dañar el ecosistema derretir el hielo sobre las calles en un plazo similar de tiempo.
De momento la efectividad y economía de la sal hace que lo utilicemos masivamente en las situaciones invernales como la que estamos viviendo. Pero además de vez en cuando oímos hablar de términos que no dejan de ser paradójicos: lluvia helada, hielo negro, hielo azul. etc.
Fuente: https://www.elenamoreno.net/