¿Por qué el agua hierve antes en la montaña? La relación inversa entre el punto de ebullición del agua y la altitud
El punto de ebullición del agua solo es de 100 ºC al nivel del mar y a la presión normal. Disminuye a medida que ganamos altura, por lo que en zonas altas de montaña el agua comienza antes a hervir.

Si nos preguntan a qué temperatura hierve el agua, la respuesta que nos viene de inmediato a la cabeza es 100 ºC, ya que es un dato vox populi, que manejamos desde nuestra etapa escolar; sin embargo, eso solamente ocurre si estamos al nivel del mar a la presión normal, de 1013 hPa. En la mayoría de los casos en que pongamos agua a calentar, su punto de ebullición se alcanzará a una temperatura diferente y menor a esos 100 ºC.
Dicha circunstancia tiene importantes implicaciones, ligadas, por ejemplo, a la cantidad de energía (calor) que necesitaremos para lograr que el agua hierva, así como el tiempo que requerirá la cocción de los alimentos. El punto de ebullición del agua (de cualquier sustancia, en general) se define como la temperatura a la cual la presión de vapor del líquido es igual a la presión ambiental, lo que conlleva su transformación en vapor. De lo anterior se deduce que si varía la presión atmosférica lo hace el punto de ebullición.
Evaporación versus ebullición
Antes de comentar cómo varía el citado punto de ebullición del agua en función de la elevación del lugar donde nos encontremos, explicaremos algunos detalles sobre el proceso físico (termodinámico) del cambio de fase líquida a gaseosa, ya que existe cierta confusión sobre el concepto “evaporación”. Es relativamente común identificar el momento en que el agua empieza a hervir en un recipiente puesto al fuego con la evaporación de la misma. Lo cierto es que con independencia de la temperatura a la que esté el agua, sobre su superficie en contacto con el aire siempre hay una determinada tasa de evaporación.
Para darnos cuenta de esto, basta con que dejemos un vaso con cierta cantidad de agua en una mesa que tengamos en nuestra casa para que, pasado un tiempo (mayor o menor en función de la cantidad de líquido y la temperatura que vaya habiendo en la vivienda), termine evaporándose en su totalidad. Para cada temperatura ambiente se establece un equilibrio entre las moléculas de agua líquida que se incorporan como vapor de agua al aire, y las de este gas que se incorporan al líquido.
Si la temperatura del liquido aumenta progresivamente (que es lo que hacemos al calentar una cazuela con agua), entonces la tasa de evaporación no para de aumentar hasta que llega un momento en que el líquido se llena de burbujas de que tienden a escapar al aire. El borboteo es el que marca el punto de ebullición del agua y se alcanzará a una temperatura mayor o menor en función de cuál sea la presión atmosférica, cuyo valor es una medida indirecta de la densidad del aire y del contenido de vapor de agua del mismo.
Si estamos al nivel del mar y la presión es justamente de 1013 hPa, entonces el agua comenzará a hervir a 100 ºC, que es lo que nos enseñaron en el colegio. Si medimos con precisión la temperatura durante la ebullición posiblemente no coincida exactamente con ese valor, ya que el agua que consumimos (o la que sale del grifo o embotellada) no es agua pura, sino que lleva disueltas distintas sales y otros elementos, pero grosso modo podemos considerar que a nivel del mar el agua hierve a 100 ºC.
Did you know?
— Massimo (@Rainmaker1973) May 5, 2025
The temperature at which water boils depends on pressure.
You can easily demonstrate this by dramatically lowering the pressure on a water-filled plastic syringe at room temperature.
[ Alissa Killian]pic.twitter.com/UxGMkSARrP
La presión atmosférica no solo varía al ascender o descender, sino en cualquier nivel atmosférico, como consecuencia del trasiego de borrascas y anticiclones que caracterizan al tiempo meteorológico. Podemos estar al nivel del mar, pero con una presión mucho mayor o mucho menor que la normal (esos 1013 hPa), lo que hará que el punto de ebullición se alcance a una temperatura algo mayor o menor que los 100 ºC teóricos.
¿A qué temperatura hierve el agua en el Everest?
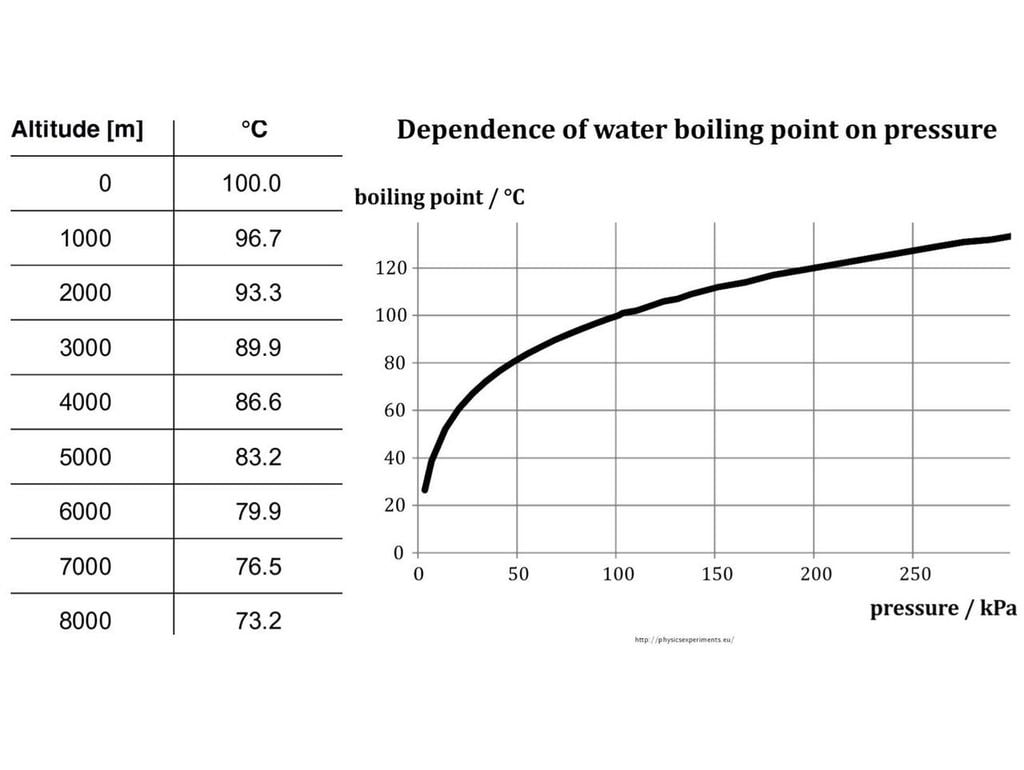
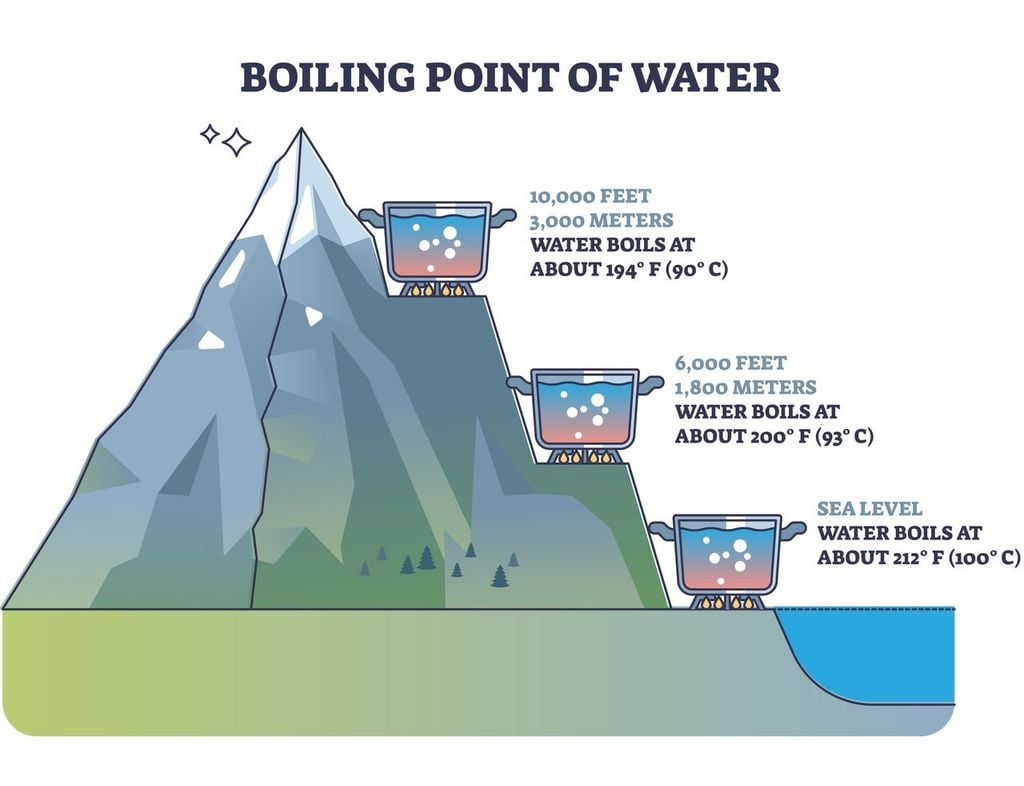
A medida que vayamos ganando metros hacia arriba con respecto al nivel del mar, la progresiva disminución de la presión atmosférica hace que el punto de ebullición vaya también disminuyendo de forma sistemática. En una de las figuras que acompaña este artículo vemos en una tabla que a 3.000 m de altitud el agua empieza a hervir a 90 ºC aproximadamente (89,9 ºC), mientras que a 6.000 m lo hace a 80 ºC (también redondeando).

Viajemos por un momento a la cumbre más alta de la Tierra: el Everest, cuya elevación oficial es de 8.849 m. Allí arriba, donde la sequedad del aire es muy alta, el punto de ebullición es ligeramente inferior a los 70 ºC. Aunque ningún montañero de los que logran hacer cima se plantea ponerse a preparar una paella en plena cumbre, no faltan quienes han estimado los tiempos de cocción del arroz en función de la altitud.
Si partimos de que en Valencia, al nivel del mar, se requieren 15 minutos con el arroz en el agua hirviendo para que esta se evapore en su totalidad y la paella esté a punto, a 4.000 metros de altitud se requiere casi el doble de tiempo de cocción (29 minutos), de donde podemos extrapolar que si algún intrépido montañero desafiara el reto de preparar una paella en la cima del Everest, solo la cocción le llevaría más de una hora. No es probable que alguien consiga hacer algo así, principalmente por una cuestión de pura supervivencia.
No te pierdas la última hora de Meteored y disfruta de todos nuestros contenidos en Google Discover totalmente GRATIS
+ Seguir a Meteored



