Nieve ácida y su fusión en tierra
Una clarificación inicial que será provechosa. La “nieve ácida” se refiere realmente a la acidez del agua derretida, porque el pH, discutido abajo, se refiere a soluciones líquidas del agua.
WeatherwiseTom Schlatter
Síguenos en Twitter https://twitter.com/RAM_meteo @RAM_meteo
Pregunta a la revista
Vivo fuera de New York City en el condado de Westchester, Nueva York. Recuerdo que la nieve duraba en tierra mucho tiempo después de una tempestad de nieve, pero durante los últimos años, la nieve parece desaparecer más rápidamente, y no solo debido a los quitanieves. Expongo aquí está, mi hipótesis: La lluvia ácida es conocida en el noreste, así que debe haber también nieve ácida, y la acidez es una razón por la que se derrite más rápidamente.
Paul Grimaldi Yonkers, Nueva York
Respuesta de Tom Schlatter
Una clarificación inicial que será provechosa. La “nieve ácida” se refiere realmente a la acidez del agua derretida, porque el pH, discutido abajo, se refiere a soluciones líquidas del agua.
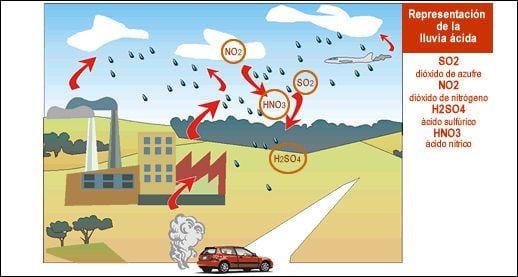
Usted está en lo correcto que la nieve ácida es tan probable como la lluvia ácida. Sobre áreas pobladas, hay siempre partículas microscópicas numerosas en el aire. Algunas ocurren naturalmente, pero se derivan más de las emisiones industriales y de otras actividades humanas. Muchas de estas partículas son higroscópicas, es decir, atraen el vapor de agua. Cuando el vapor de agua condensa en estas partículas, disuelven en una solución que pueda ser ácida o alcalina, pero son a menudo posiblemente ácidas. Ése es el origen de la lluvia ácida.
Los cristales de la nieve se forman sobre partículas microscópicas también, pero la partícula no se disuelve hasta que el cristal se derrite, a menudo no hasta después de que la nieve se ha acumulado en la tierra. En esa manera de la nube a la tierra, las gotas de agua y de los cristales de nieve pueden chocar con otras partículas y recogerlas, de tal modo que llegan a ser más ácidos, pero las gotas de agua son más eficientes en esto que los copos de nieve. Las gotas de agua también absorben el dióxido de carbono atmosférico, mientras que no lo hacen los copos de nieve a menos que se derritan parcialmente. Por estas razones, la lluvia es generalmente más ácida que la nieve derretida.
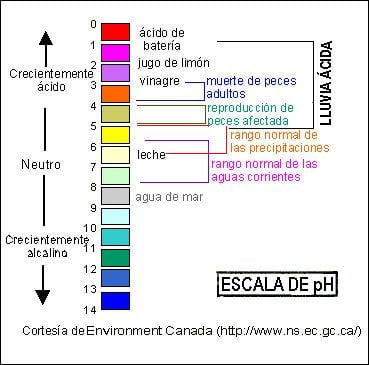
El pH es una medida de la acidez o de la alcalinidad de una solución en una escala logarítmica que va del 0 hasta 14. Un pH de 7 es neutral; los valores más bajos son valores más ácidos, y los más altos más alcalinos. El agua destilada tiene un pH de 7.0, que es ni ácido ni alcalino. Como ejemplos de incrementos de la acidez, el jugo de zanahoria tiene un pH de cerca de 6.0, la sandía 5.4, el jugo de tomate 4.3, el zumo de naranja 3.7, y el jugo de limón llega a 2.3.
La nieve derretida en el Este de los Estados Unidos tiene normalmente un pH entre 4.6 y 6.7. ¿La nieve con este grado de acidez potencial se derrite en una temperatura más baja que la nieve con un pH de 7.0? No. La depresión de la temperatura de congelación de una solución ácida es insignificante para los valores de pH por de bajo de los 4.6 y baja considerablemente, así que uno debe mirar a otra parte para explicar porqué la nieve en la tierra no pudo retrasarse mientras lo hiciera una vez. Varias explicaciones alternativas me vienen a la mente.
Los inviernos son más cálidos en el noreste que lo eran hace tiempo, aunque los dos inviernos pasados son una revocación temporal de esta tendencia. Quizás más polvo aerotransportado u hollín ahora se asienta en la nieve que en el pasado, haciendo más oscuro la superficie, así absorbiendo más energía del Sol que una superficie blanca prístina y derritiendo la nieve más rápidamente. La longevidad temporal en que la nieve queda en la tierra también depende de la duración del frío que acompaña la nieve, que puede extenderse a partir apenas de un día a varias semanas.
Fuente: Revista Weatherwise